- Термічний спосіб [ правити | правити код ]
- Екстракційний спосіб [ правити | правити код ]
- Концентрування і очищення [ правити | правити код ]
- Економічні та екологічні аспекти [ правити | правити код ]
- Авіаційна промисловість [ правити | правити код ]
- Харчова промисловість [ правити | правити код ]
- Сільське господарство [ правити | правити код ]
- Стоматологія [ правити | правити код ]
Ортофосфорна кислота 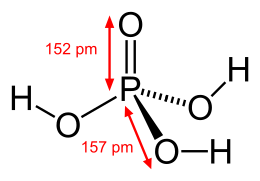
 систематичне
систематичне
найменування Ортофосфорна кислота Хім. формула H3PO4 стан тверде молярна маса 98,0 г / моль густина 1,685 (рі) динамічна в'язкість 2,4-9,4 сПуаз Т. плав. +42,35 ° C Т. кип. +158 ° C Тиск пара 0,03 ± 0,01 мм рт.ст. [1] pKa 2,12; 7,21; 12,67 розчинність в воді 548 г / 100 мл Реєстр. номер CAS 7664-38-2 PubChem 1004 Реєстр. номер EINECS 231-633-2 SMILES InChI Кодекс Аліментаріус E338 RTECS TB6300000 ChEBI 26078 номер ООН 1805 ChemSpider 979 H-фрази H290, H314 P-фрази P280, P303 + P361 + P353, P304 + P340 + P310, P305 + P351 + P338 сигнальне слово небезпечно піктограми СГС  NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Ортофосфорна кислота (фосфорна кислота) - неорганічна кислота середньої сили з хімічною формулою H3PO4, яка при стандартних умовах являє собою безбарвні гігроскопічні кристали . Зазвичай ортофосфорної (або просто фосфорної) кислотою називають 85% -ий водний розчин (безбарвна сиропообразная рідина без запаху). розчинна в етанолі та інших розчинниках.
У чистому вигляді фосфорна кислота являє собою безбарвна кристалічна речовина з температурою плавлення 42,35 ° С. кристали мають моноклинную сингонії . Тверда фосфорна кислота гігроскопічна і розпливається на повітрі; вона змішується з водою у всіх співвідношеннях, але комерційно зазвичай доступна в трьох концентраціях:
- 75% H3PO4 (т. Пл. -20 ° С);
- 80% H3PO4 (т. Пл. 0 ° С);
- 85% H3PO4 (т. Пл. 20 ° С).
З 85% -ої фосфорної кислоти можна отримати сухий при випаровуванні води в вакуумі при 80 ° С. З концентрованих розчинів вона осідає у вигляді гемігідрату H3PO4 · 0,5H2O [2] [3] .
У твердому стані і концентрованих розчинах між молекулами фосфорної кислоти існують водневі зв'язку . При зниженні концентрації до 40-50% більш стійкою є воднева зв'язок між фосфат-аніонами і молекулами води. Також в розчинах фосфорна кислота обмінюється атомами кисню з водою [3] .
Фосфорна кислота - трёхосновная кислота середньої сили. У водних розчинах вона піддається дисоціації за трьома ступенями c константами дисоціації K 1 = 7,1⋅10-3 (p Ka1 2,12); K 2 = 6,2⋅10-8 (p Ka2 7,20); K 3 = 5,0⋅10-13 (p Ka3 12,32). екзотермічну тільки дисоціація по першого ступеня; по другого і третього ступеня вона ендотермічна [4] .
Як наслідок, фосфорна кислота може утворювати як середні (фосфати), так і кислі солі (гідрофосфат і дигідрофосфат). Однак при нормальних умовах вона малоактивна і вступає в реакції тільки з карбонатами , гидроксидами і деякими металами . Вище 80 ° С фосфорна кислота реагує також з неактивними оксидами , кремнеземом і силикатами . Також фосфати утворюються в процесі фосфатирования , За допомогою якого чорні і кольорові метали покривають захисною плівкою для поліпшення їх характеристик [4] .
Нагрівання фосфорної кислоти призводить до відщеплення води з утворенням пірофосфорної кислоти і метафосфорной кислоти [4] :
2 H 3 P O 4 → H 2 O + H 4 P 2 O 7; {\ Displaystyle {\ mathsf {2H_ {3} PO_ {4} \ rightarrow H_ {2} O + H_ {4} P_ {2} O_ {7}}};} H 4 P 2 O 7 → H 2 O + 2 H P O 3. {\ Displaystyle {\ mathsf {H_ {4} P_ {2} O_ {7} \ rightarrow H_ {2} O + 2HPO_ {3}}}.}
Відмінною реакцією ортофосфорної кислоти від інших фосфорних кислот є реакція з нітратом срібла : При цьому утворюється жовтий осад, тоді як інші фосфорні кислоти дають білий осад [4] :
H 3 P O 4 + 3 A g N O 3 → A g 3 P O 4 + 3 H N O 3. {\ Displaystyle {\ mathsf {H_ {3} PO_ {4} + 3AgNO_ {3} \ rightarrow Ag_ {3} PO_ {4} + 3HNO_ {3}}}.}
Якісною реакцією на іон H2РО4- є утворення яскраво-жовтого осаду молібденофосфата амонію:
H 3 PO 4 + 12 [NH 4] 2 M o O 4 + 21 HNO 3 → [NH 4] 3 PM o 12 O 40 ⋅ 6 H 2 O ↓ + 21 NH 4 NO 3 + 6 H 2 O {\ displaystyle {\ mathsf {H_ {3} PO_ {4} +12 [NH_ {4}] _ {2} MoO_ {4} + 21HNO_ {3} \ rightarrow [NH_ {4}] _ {3} PMo_ {12} O_ {40} \ cdot 6H_ {2} O \ downarrow + 21NH_ {4} NO_ {3} + 6H_ {2} O}}}
Вперше фосфорну кислоту з оксиду фосфору (V) отримав Роберт Бойль в 1694 році [2] . Лабораторний метод отримання полягає в окисленні фосфору азотною кислотою [4] :
3 P + 5 H N O 3 + 2 H 2 O → 3 H 3 P O 4 + 5 N O. {\ Displaystyle {\ mathsf {3P + 5HNO_ {3} + 2H_ {2} O \ rightarrow 3H_ {3} PO_ {4} + 5NO}}.}
Термічний спосіб [ правити | правити код ]
У промисловості використовують два основних способи отримання фосфорної кислоти: термічний і екстракційний. Термічний спосіб полягає в спалюванні фосфору до оксиду фосфору (V) і реакції останнього з водою [5] :
P 4 + 5 O 2 → P 4 O 10; {\ Displaystyle {\ mathsf {P_ {4} + 5O_ {2} \ rightarrow P_ {4} O_ {10}}};} P 4 O 10 + 6 H 2 O → 4 H 3 P O 4. {\ Displaystyle {\ mathsf {P_ {4} O_ {10} + 6H_ {2} O \ rightarrow 4H_ {3} PO_ {4}}}.}
Технічно цей процес реалізується по-різному. У так званому IG-процесі (від назви фірми IG) обидві реакції проводяться в одній реакційної колоні. Зверху в неї стисненим повітрям або парою під тиском 1,5 МПа через сопло подається фосфор, який згорає при температурі> 2000 ° C. Отриманий оксид фосфору (V) поглинається фосфорною кислотою, яка стікає зверху по стінках колони, цілком покриваючи їх. При цьому вона одночасно виконує кілька функцій: розчиняє оксид фосфору (V), відводить теплоту з реакції згоряння і захищає стінки колони від полум'я. Отримана фосфорна кислота збирається під колоною, пропускається через теплообмінник і подається в верхню частину колони, звідки знову стікає по стінках. Матеріалом для установки по отриманню фосфорної кислоти служить нержавіюча сталь з низьким вмістом вуглецю. До 100 ° C вона стійка до концентрованої фосфорної кислоти [6] .
Отримана цим способом фосфорна кислота практично не містить домішок сполук фосфору в нижчих ступенях окислення (вміст фосфористої кислоти H3PO3 становить всього 0,1%). Однак її необхідно очистити від домішкового миш'яку , Який в низьких концентраціях міститься навіть в дуже чистому фосфорі. Ця очищення здійснюється впливом сірководню (Для його отримання в фосфорну кислоту вводять сульфід натрію ) І осадженням сульфіду миш'яку з наступним фільтруванням [6] .
На цих реакціях заснований також TVA-процес (від Tennessee Valley Authority [En] ), Однак спалювання фосфору і поглинання оксиду фосфору (V) проводиться окремо. Фосфор і повітря подаються в сталеву камеру згоряння із зовнішнім охолодженням, після чого продукти згорання через верхню частину камери підпадають в камеру поглинання, де і утворюється фосфорна кислота [7] . У Хезст-процесі (від назви фірми Hoechst ) Згоряння і поглинання проводяться окремо, проте він відрізняється тим, що теплота згоряння фосфору там використовується для генерування пари [5] .
Екстракційний спосіб [ правити | правити код ]
Екстракційний спосіб виробництва фосфорної кислоти полягає в обробці природних фосфатів неорганічними кислотами (В країнах СНД переважно Хибинского апатитового концентрату і фосфоритів Каратау [8] ). фосфати обробляли сірчаною кислотою ще в середині 1880-х рр., проте розвиток цієї галузі почалося після Другої світової війни завдяки підвищеному попиту на мінеральні добрива [9] .
Розкладання сировини відбувається за такою схемою (x від 0,1 до 2,2):
C a 5 (P O 4) 3 F + 5 H 2 S O 4 + 5 x H 2 O → 5 C a S O 4 ⋅ x H 2 O + 3 H 3 P O 4 + H F. {\ Displaystyle {\ mathsf {Ca_ {5} (PO_ {4}) _ {3} F + 5H_ {2} SO_ {4} + 5xH_ {2} O \ rightarrow 5CaSO_ {4} \ cdot xH_ {2} O + 3H_ {3} PO_ {4} + HF}}.}
Побічним продуктом цієї реакції є сульфат кальцію , Який в залежності від температури і концентрації фосфорної кислоти може випадати у вигляді дигідрату (CaSO4 · 2H2O) або гемігідрату (CaSO4 · 0,5H2O). За цією ознакою екстракційні процеси отримання фосфорної кислоти ділять на дігідратние, гемігідратние і комбіновані (дігідратно-гемігідратний і гемігідратно-дігідратний). Існує також ангідрітние метод (з осадженням безводного сульфату кальцію ), Який, однак, в промисловості не використовується, так як він пов'язаний з серйозними корозійними проблемами [9] .
Дігідратний процес є класичним методом отримання фосфорної кислоти. Його переваги полягають у відносно низькій температурі, завдяки чому вдається уникнути корозії. Крім того, можна використовувати різну фосфатне сировину і переробляти його в великих кількостях. Для початку сировину подрібнюють до розміру часток менше 150 мкм. Фосфат і сірчана кислота подаються в реактор окремо, щоб освіту шару сульфату кальцію на частки не ускладнювало подальшого розкладання. Температура процесу становить 70-80 ° С, а концентрація фосфорної кислоти в системі дорівнює 28-31% в перерахунку на P2O5. У цих умовах сульфат кальцію утворюється у вигляді дигідрату. Недоліком методу є те, що вихідна сировина необхідно перемелювати, а отриману фосфорну кислоту додатково концентрувати до 40-55% і навіть до 70% P2O5 [10] .
Гемігідратний процес був розроблений для того, щоб уникнути необхідності концентрування отриманої фосфорної кислоти. Він проводиться при більш високій температурі (80-100 ° С) - в умовах, коли більш стійкою формою є гемігідрат сульфату кальцію. Фосфорна кислота при цьому виходить в концентрації 40-48% [10] . Гемігідратно-дігідратний процес розроблений в Японії в зв'язку з тим, що він дозволяє отримувати практично чистий гіпс , Поклади якого в цій країні відсутні. Обробка сировини ведеться при високій температурі, і утворюється гемігідрат сульфату кальцію, однак потім його перекрісталлізовивают в дигідрат [10] .
Концентрування і очищення [ правити | правити код ]
Для концентрування фосфорної кислоти, отриманої дігідратним процесом, використовують вакуумне випаровування, хоча на старих заводах досі застосовують Занурювальне горіння . Іноді використовують послідовно декілька випарників, так що пари з одного випарника використовуються для нагріву розчину в наступному випарнику. Крім того, при випаровуванні води з фосфорної кислоти також видаляється фтор у вигляді суміші SiF4 і HF . Так, при підвищенні концентрації фосфорної кислоти з 30 до 50% P2O5 з неї видаляється 50-60% фтору. Оскільки викиди фтору регулюються законами, ці речовини направляють на виробництво кремнефтористоводородной кислоти H2SiF6 [11] .
Різноманітні неорганічні домішки видаляють осадженням і екстракцією . Осаджувати необхідно домішки миш'яку (у вигляді сульфіду миш'яку), кадмію (У вигляді комплексу з ефірами дітіофосфорной кислоти ), А також домішки катіонних металів (обробкою гідроксидом натрію ). Екстракція заснована на перекладі фосфорної кислоти в органічну фазу і системи очистки водою, розведеною фосфорною кислотою і розчинами фосфатів. При цьому видаляються як катіонні, так і аніонні домішки. Сама фосфорна кислота відокремлюється від розчинника перегонкою . Як розчинники використовують бутанол-1 , аміловий спирт , метилізобутилкетон , трибутилфосфат , диізопропіловий ефір та ін. [12]
Економічні та екологічні аспекти [ правити | правити код ]
Світова потреба в фосфорної кислоти за станом на 1989 р оцінюється в 40,6 млн тонн на рік в перерахунку на P2O5. Екстракційний спосіб виробництва є переважаючим (95% від загальної кількості), оскільки він споживає менше енергії. Решта 5% виробляються термічним способом. Основним виробником (і споживачем) екстракційної фосфорної кислоти є США : Їх частка від загального виробництва фосфорної кислоти становить 90% [13] .
У 1980-і рр. відбулося скорочення виробництва фосфорної кислоти через відмову від фосфоровмісних детергентів і мінеральних добрив. Це було пов'язано з забрудненням фосфатними добривами грунтових вод і евтрофікацією водойм [13] .
Екстракційне виробництво фосфорної кислоти пов'язано з утворенням відвалів сульфату кальцію : На 1 т P2O5 проводиться 4,5-5,5 т забрудненого сульфату кальцію, який необхідно утилізувати. Станом на 2008 рік існує три варіанти:
- затоплення в водоймах (10%);
- звалювання на суші (близько 88%);
- використання в якості сировини [14] .
При затопленні в водоймах сульфат кальцію швидко розчиняється: його розчинність в морській воді становить 3,5 г / л, а природний вміст - 1,6 г / л. домішки оксиду кремнію і оксиду алюмінію залишаються нерозчинених. Забруднення води важкими металами мало в порівнянні з існуючими концентраціями, проте забруднення кадмієм значно [14] .
використовується при пайку в якості флюсу (По окисленої міді , по чорному металу , по нержавіючої сталі ), Для досліджень в галузі молекулярної біології. Застосовується також для очищення від іржі металевих поверхонь. Утворює на обробленої поверхні захисну плівку, запобігаючи подальшу корозію . Також застосовується в складі фреонів, в промислових морозильних установках як сполучна речовина.
Авіаційна промисловість [ правити | правити код ]
В авіаційної промисловості ортофосфорна кислота використовується в складі гідрожідкості НГЖ-5У та її іноземних аналогів.
Харчова промисловість [ правити | правити код ]
Ортофосфорна кислота зареєстрована в якості харчової добавки E338 . застосовується як регулятор кислотності в газованих напоях , наприклад, в Кока-Колі . За смаком підсолоджені слабкі водні розчини ортофосфорної кислоти нагадують агрус.
Сільське господарство [ правити | правити код ]
У звероводстве (зокрема, при вирощуванні норок) використовують випоювання розчину ортофосфорної кислоти для профілактики підвищеного рН шлунка і сечокам'яної хвороби.
Також її застосовують в гідропонних системах для регулювання рівня pH живильного розчину.
Стоматологія [ правити | правити код ]
Ортофосфорна кислота застосовується для протруювання (зняття змащеного шару) емалі і дентину перед пломбуванням зубів. При застосуванні адгезивних матеріалів 2-го і 3-го поколінь потрібно протруювання емалі зуба кислотою з подальшим промиванням і просушуванням. Крім додаткових тимчасових витрат на проведення, дані етапи несуть в собі небезпеку виникнення різних помилок і ускладнень.
При нанесенні ортофосфорної кислоти складно проконтролювати ступінь і глибину демінералізації дентину і емалі. Це призводить до того, що нанесений адгезив в повному обсязі (не по всій глибині) заповнює відкриті дентинні канальці, а це в свою чергу не забезпечує утворення повноцінного гібридного шару.
Крім того, не завжди вдається повністю видалити ортофосфорну кислоту після її нанесення на дентин. Це залежить від того, яким способом сгущена фосфорна кислота. Залишки ортофосфорної кислоти погіршують міцність зв'язування, а також призводять до утворення так званої «кислотної міни».
З появою адгезивних матеріалів 4-го і 5-го поколінь стали використовувати техніку тотального протравлювання (дентин - емаль). У адгезивних системах 6-го і 7-го поколінь окремий етап протруювання кислотою відсутня, так як адгезиви є самопротравлівающие. Однак деякі виробники все ж рекомендують для посилення адгезії короткочасно протравливать емаль навіть при використанні самопротравлівающие адгезивов.
Фосфорна кислота не робить специфічного токсичного дії. Системна токсичність низька. Її розчини подразнюють очі, дихальні шляхи і слизові оболонки. При концентрації> 10% вона подразнює, а вище 25% - також корозійне . При ковтанні великої кількості виникає нудота , блювота , діарея , Кривава блювота і гіповолемічний шок . Концентровані розчини викликають опіки слизової оболонки рота, стравоходу і шлунка. При попаданні рекомендується промити шкіру або промити очі теплою водою або фізіологічним розчином . При ковтанні фосфорної кислоти в якості першої допомоги необхідно підтримувати дихання і внутрішньовенно заповнювати рідину [15] .
У добровольців, які отримували фосфорну кислоту перорально в кількості 2-4 г / кг в день протягом 10 днів або 3,9 г / кг в день протягом 14 днів, не виявлено негативних для метаболізму наслідків. Допускається використовувати 0,5-1 г / л фосфорної кислоти в напоях [15] .
- ↑ http://www.cdc.gov/niosh/npg/npgd0506.html
- ↑ 1 2 Ullmann, 2008 , P. 679.
- ↑ 1 2 Хімічна енциклопедія, 1998. , С. 153-154.
- ↑ 1 2 3 4 5 Хімічна енциклопедія, 1998. , С. 154.
- ↑ 1 2 Ullmann, 2008 , P. 681.
- ↑ 1 2 Ullmann, 2008 , P. 681-682.
- ↑ Ullmann, 2008 , P. 683.
- ↑ Хімічна енциклопедія, 2008 , С. 301.
- ↑ 1 2 Ullmann, 2008 , P. 684.
- ↑ 1 2 3 Ullmann, 2008 , P. 686.
- ↑ Ullmann, 2008 , P. 688.
- ↑ Ullmann, 2008 , P. 689-690.
- ↑ 1 2 Ullmann, 2008 , P. 690.
- ↑ 1 2 Ullmann, 2008 , P. 691.
- ↑ 1 2 Ullmann, 2008 , P. 721.
- Букколіні Н. В. Фосфорна кислота // Хімічна енциклопедія: у 5 т / Зефиров Н. С. (гол. Ред.) . - М.: Велика Російська енциклопедія , 1998. - Т. 5: Триптофан-Ятрохімія. - С. 153-156. - 783 с. - 10 000 прим. - ISBN 5-85270-310-9 .
- Schrödter K., Bettermann G., Staffel T., Wahl F., Klein T., Hofmann T. Phosphoric Acid and Phosphates (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. - Wiley, 2008. - DOI : 10.1002 / 14356007.a19_465.pub3 .
- Карапетьянц М. Х. Дракин С. І. Загальна та неорганічна хімія. М .: Хімія1994
- Блум У. Адгезивні системи огляд і порівняння // Дент. Арт.- 2003 № 2.-С.5-11.
- Давидова А. В. Характеристика адгезивних систем // Матеріали науково-практичної конференції «Нові технології в стоматології» .- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers // CRA Newsletter.- Vol.24, № 11.-2000.-P.1-2.




